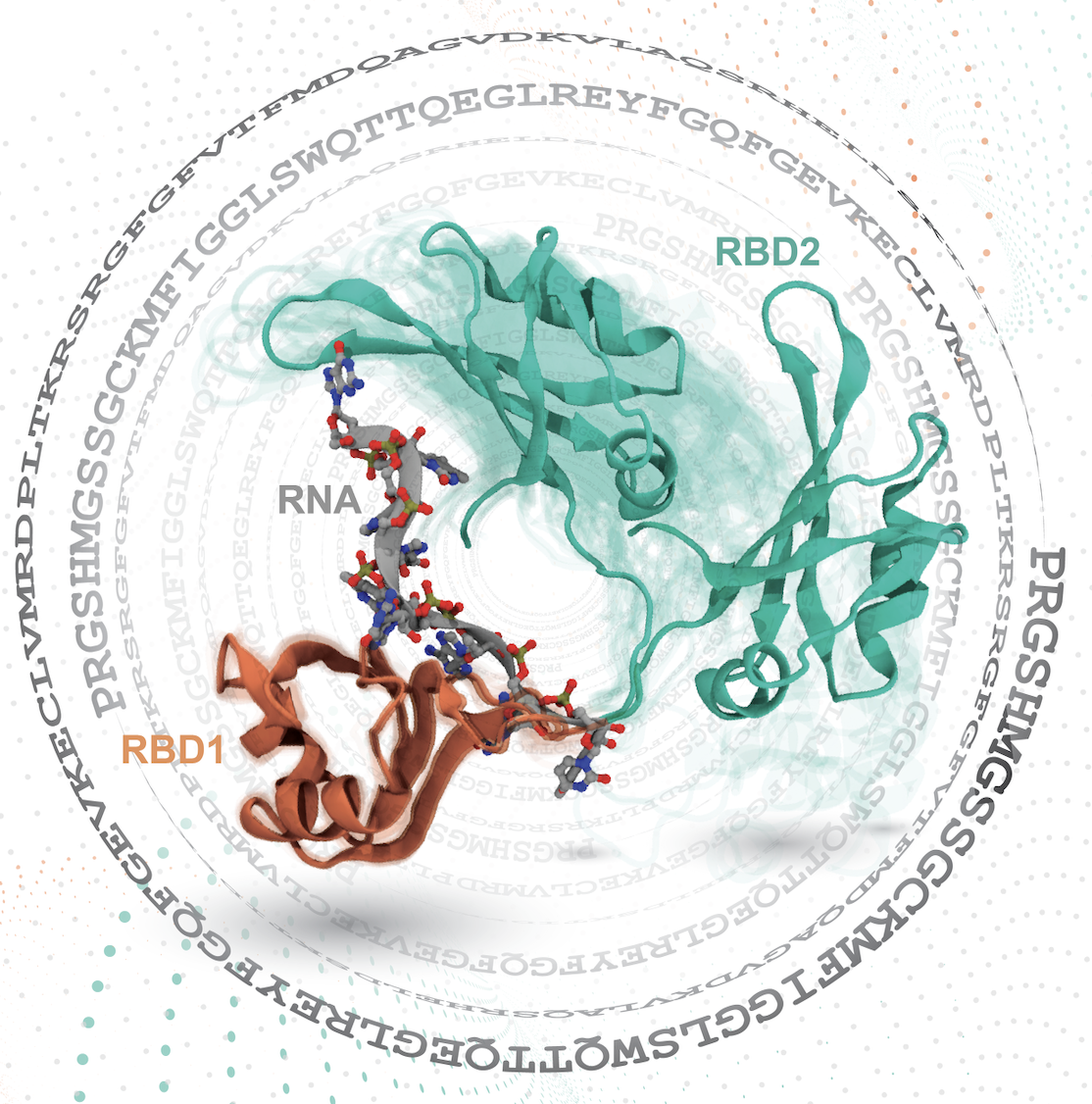
観測が難しい生体分子の「うごき」を捉えるシミュレーション手法の開発

「かたち」だけでは機能はわからない
生体内に存在するタンパク質や核酸をはじめとする生体分子は、常に揺らぎながらお互いに結合したり解離したりすることで機能しています。
複雑な機能を明らかにするためには、 生体分子の「うごき」を詳しく調べる必要があります。例えば、タンパク質が核酸と結合して機能する場合、両分子は互いの「かたち」を大きく変化させます。このことから、生体分子が止まっている「かたち」をじっと眺めているだけでは、機能を明らかにすることはできないことがわかります。
実験技術の発展により、生体分子の「かたち」を高い精度で決定できるようになってきましたが、生体分子の「うごき」を調べることは簡単ではありません。
分子シミュレーションで調べる
生体分子の機能に関わる重要な「うごき」を調べるうえで、分子シミュレーションは強力なアプローチです。その中でも、分子動力学シミュレーションは生体分子の「うごき」を詳しく調べることができる「計算機顕微鏡」です。
原理的には、生体分子を構成している全ての原子について運動方程式を数値的に解くことで、時々刻々変化する「うごき」を追跡できます。
1000倍以上ものギャップ
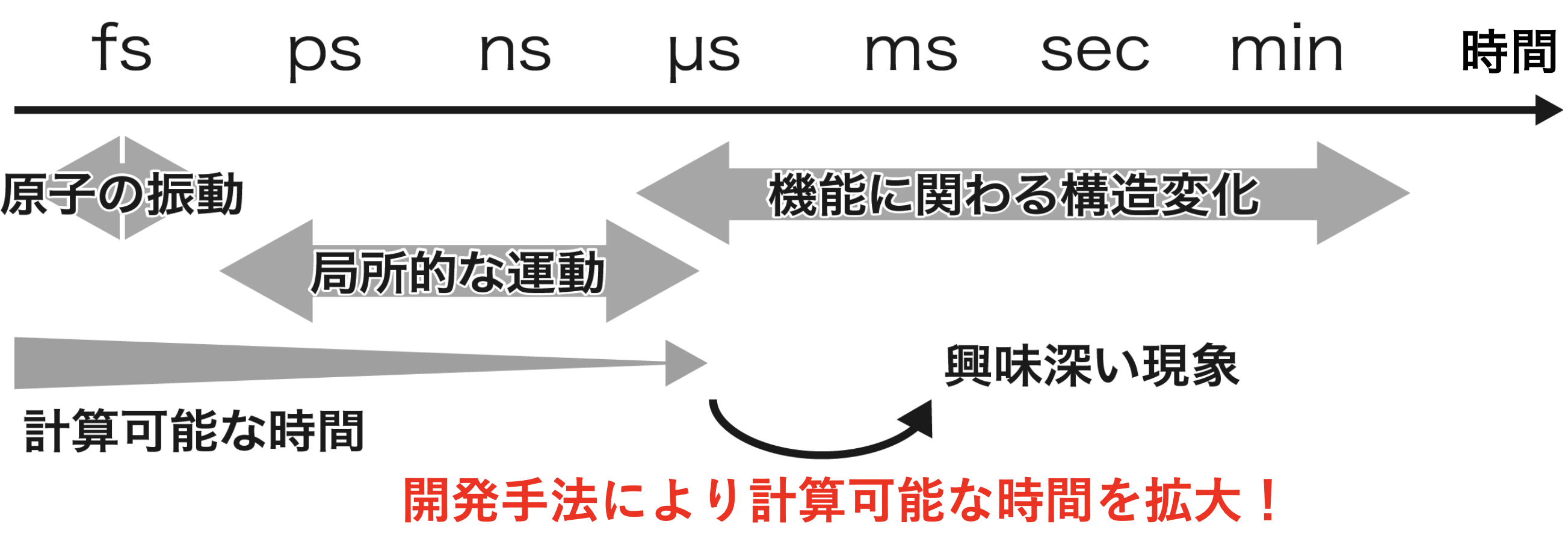
運動方程式はコンピューターを用いることで数値的に解くことができますが、計算技術的な問題から機能に関わる重要な「うごき」を抽出することは難しいことが知られています。
なぜならば、コンピューターで追跡できる時間スケールと機能に関わる重要な「うごき」が観測される時間スケールとの間に大きなギャップが存在するからです。
数値的に言うと、現状の分子動力学シミュレーションが到達できる時間スケールはマイクロ秒 (10-6秒) 程度であるのに対し、機能に関わる重要な「うごき」が観測される時間スケールはミリ秒 (10-3秒) 以上であり、1000倍以上ものギャップが存在します。
到達できる時間スケールを拡大
このように、分子動力学シミュレーションは生体分子の「うごき」を調べることができる強力なツールであるにもかかわらず、そのストロングポイントを十分に活かしきれていません。
そこで私は、この問題を解決するために分子動力学シミュレーションを改良し、到達できる時間スケールを拡大することで機能に関わる重要な「うごき」を抽出できる計算手法を新たに開発しました。
機能に関わる重要な「うごき」を抽出するためには、ミリ秒以上におよぶ長時間の分子動力学シミュレーションを実行すれば良いわけですが、現実的ではありません。そこで私は、短時間の分子動力学シミュレーションをうまく利用することで、長時間において観測される「うごき」を抽出できないか考えました。
具体的には、短時間の分子動力学シミュレーションを実行している間に「うごきやすい状態」を見つけ出し、それらから分子動力学シミュレーションを繰り返すというトリックです。
このトリックにしたがうと、つねに「うごきやすい状態」から同時多発的に分子動力学シミュレーションが開始されるため、機能に関わる重要な「うごき」を抽出できる可能性が飛躍的に高まります。
「うごきやすい状態」から短時間の分子動力学シミュレーションを繰り返しているだけという極めて単純なアイディアにもかかわらず、生体分子が機能するために重要な「うごき」を意外と簡単に抽出できるという点がオリジナリティです。現在、この手法は様々なタンパク質に適用され、長時間スケールで観測される機能に関わる重要な「うごき」の抽出に役立っています。
「生物物理学」が 学べる大学・研究者はこちら(※みらいぶっくへ)
その領域カテゴリーはこちら↓
「7.生物・バイオ」の「21.分子生物学・細胞生物学・発生生物学、生化学(生理・行動・構造等 基礎生物学も含む)」
◆ 原田研究室HP

◆主な業種
(1) 医療機器
(2) コンピュータ、情報通信機器
(3) 化学/化粧品・繊維・衣料/化学工業製品・石油製品
◆主な職種
(1) 基礎・応用研究、先行開発
(2) 設計・開発
(3) コンサルタント(ビジネス系等)